出典:Uchihashi T, Watanabe YH, Nakazaki Y, Yamasaki T, Watanabe H, Maruno T, Ishii K, Uchiyama S, Song C, Murata K, Iino R and Ando T
Dynamic structural states of ClpB involved in its disaggregation function Nat. Commun. 2018
要旨
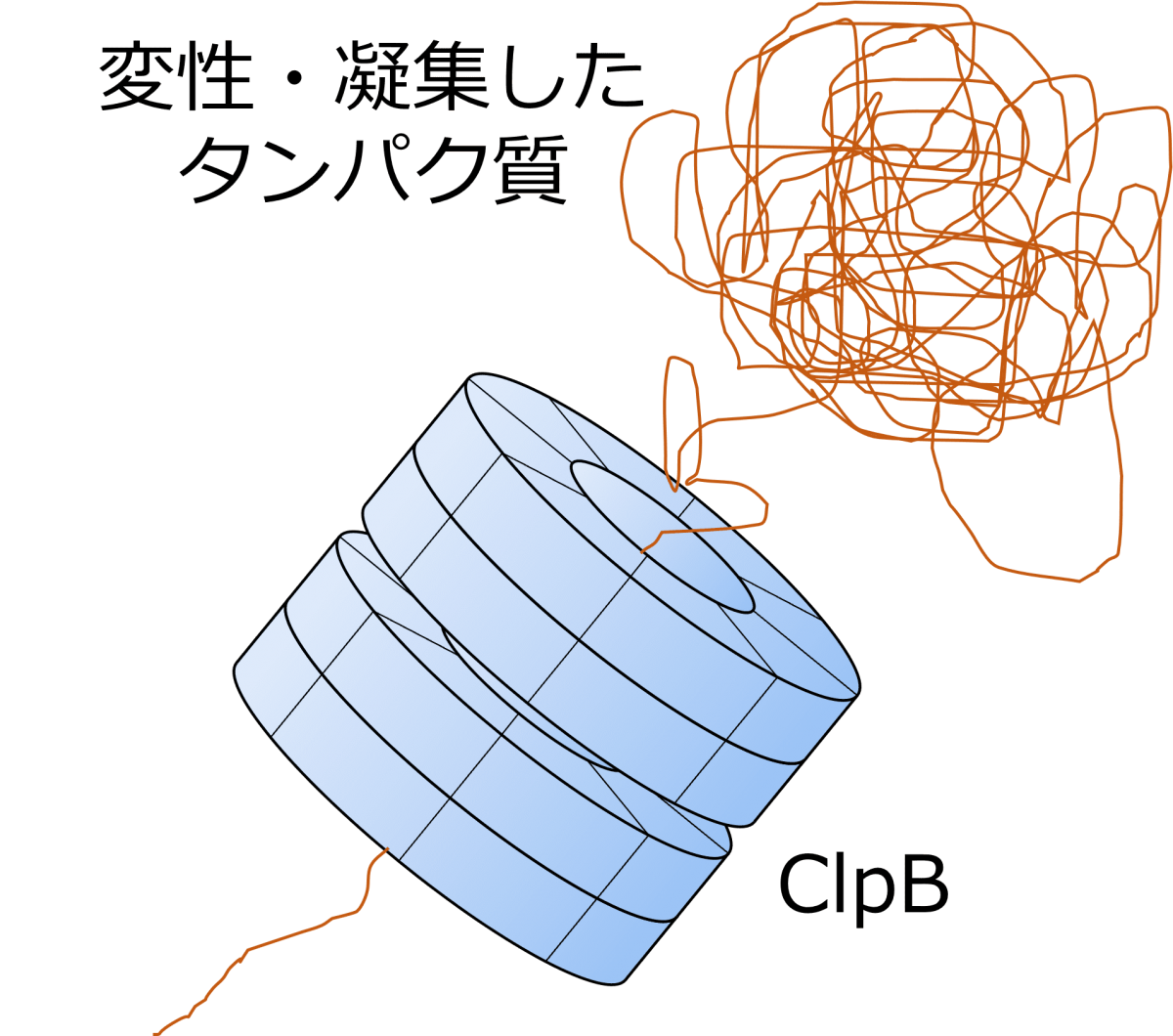
熱などのストレスによりタンパク質の折り畳み構造が変わることを「変性」と呼ぶ。
生体内で変性タンパク質は凝集し、アルツハイマー型認知症などの疾患の原因となる。
ClpBは変性タンパク質の修復(リフォールディング)に関与するシャペロンタンパク質である。
凝集した変性タンパク質がClpBのリング中央部位を通過すると、変性タンパク質は解きほぐされる。
そして、解きほぐされた変性タンパク質は、シャペロンタンパク質であるHsp70によってリフォールディングされると推測されている。
このリフォールディングにおいて、ClpBがタンパク質を解きほぐす詳しい仕組みは明らかになっていない。
本研究では、高速AFMを用いてClpBの構造変化を調べることで、リフォールディングのメカニズムを明らかにする上で重要な知見を得た。
Keyword: ClpB(Caseinolytic peptidase B protein homolog)
ClpBはリング状構造を持つシャペロンタンパク質であり、モノマーであるTClpBが重合することで形成される。
凝集した変性タンパク質はリング中央を通過して解きほぐされ、Hsp70に引き渡される。
観察結果
高速AFMを用いたClpB一分子の構造観察により、系にATPが存在するとClpBの立体構造が変化し
リング状・らせん状・ねじれ状の異なる構造をとる様子が観察された。
ClpBのAAA2部位の加水分解能を抑制した変異体ではこの構造変化が起こらなかったことから、
AAA2部位でのATP加水分解が、この立体構造変化に寄与していることがわかった。
さらに、TClpBが正しく重合してClpBを形成するには、AAA1およびAAA2部位へのATPの結合が必要であることも明らかになった。
本研究で得られた知見は、ClpBがタンパク質を解きほぐす仕組みの解明に大きく貢献すると期待される。
高速AFM観察画像

構造変化するClpBのスナップショット(10 μM ATP)
ATP存在下でClpBは、(a)リング状(b)らせん状(c)ねじれ状
の異なる構造をとる様子が観察された。
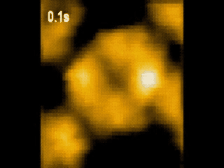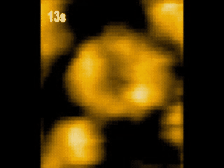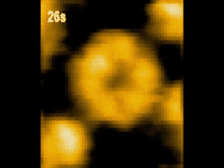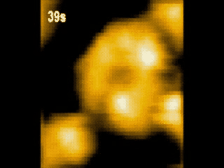
高速AFMによるClpB構造変化の経時観察像(10 μM ATP)
関連するWebコンテンツのご紹介
下記リンクから動画等をご覧いただけます。
出典論文
Uchihashi T, et al.
Dynamic structural states of ClpB involved in its disaggregation function.
Nat Commun. 2018 Jun 1;9(1):2147. doi: 10.1038/s41467-018-04587-w.
https://www.nature.com/articles/s41467-019-11204-x